Reacciones químicas sorprendentes en Gifs
Anuncios Google
- Streaming en directowww.multistream.tv - La mejor plataforma para eventos en Directo a tu alcance

Espera un minuto para que se cargen todos los gifs...


En caso de que se caiga una , con "F5"


 Que tal usuarios de Taringa! ¿Cómo andan? que bien, navegando un día por YouTube me encontré con un par de experimentos químicos muy interesantes
Que tal usuarios de Taringa! ¿Cómo andan? que bien, navegando un día por YouTube me encontré con un par de experimentos químicos muy interesantes 
 , alguno que otro conocido, alguno que otro mejor, alguno que otro muy bueno
, alguno que otro conocido, alguno que otro mejor, alguno que otro muy bueno 
 , etc. Pero lo que importa es que, como interesado en este tipo de cosas, decidí traer algunos para compartirlos aquí en T!.
, etc. Pero lo que importa es que, como interesado en este tipo de cosas, decidí traer algunos para compartirlos aquí en T!. 

 Entre tanto videos que vi, recolecté un total de 15 y los he pasado a formato "Gif" para hacer del post un poco más dinámico y atractivo. Espero que los disfruten
Entre tanto videos que vi, recolecté un total de 15 y los he pasado a formato "Gif" para hacer del post un poco más dinámico y atractivo. Espero que los disfruten 

 Aviso
que puede suceder que la química como a algunos seguramente no sea de
tu agrado y en caso de ser así, te recomiendo que no continúes viendo el
post por que es posible que te aburras.
Aviso
que puede suceder que la química como a algunos seguramente no sea de
tu agrado y en caso de ser así, te recomiendo que no continúes viendo el
post por que es posible que te aburras. 

Pero en caso de que sí te interese continua adelante y ojala que lo disfrutes.


Bueno sin más preambulo, empecemos...

Estallido entre sodio metálico y el agua


El
sodio elemental reacciona fácilmente con el agua y forma una disolución
incolora, que consiste en hidróxido de sodio (sosa cáustica) e
hidrógeno gas. Se trata de una reacción exotérmica. El sodio metal se
calienta y puede entrar en ignición y quemarse dando lugar a una
característica llama naranja. El hidrógeno gas liberado durante el
proceso de quemado reacciona fuertemente con el oxígeno del aire.
Ciertos compuestos de sodio no reaccionan de manera tan inmediata con el agua, pero de todas formas son solubles en agua.
Ciertos compuestos de sodio no reaccionan de manera tan inmediata con el agua, pero de todas formas son solubles en agua.

Gas marrón resultante entre ácido nítrico y magnesio


Lo
que resulta de la combinación del Ácido Nítrico y el Magnesio sólido es
el Nitrato de Magnesio y agua, con desprendimiento de dióxido de
nitrógeno gaseoso de color marrón claro. Como se ve, la reacción se
realiza violentamente (el ácido está muy concentrado)
El ácido nítrico ataca a la mayor parte de los metales, incluso a la plata y al cobre. Las únicas excepciones son los metales nobles: oro, platino e iridio. Algunos metales, como el hierro, el cromo y el aluminio no son atacados porque se pasivan, es decir, se forma una fina capa de óxido que protege al metal del ataque del ácido. Con el cinc pasa algo similar, pero finalmente la capa de óxido es atacada por el ácido nítrico.
El ácido nítrico ataca a la mayor parte de los metales, incluso a la plata y al cobre. Las únicas excepciones son los metales nobles: oro, platino e iridio. Algunos metales, como el hierro, el cromo y el aluminio no son atacados porque se pasivan, es decir, se forma una fina capa de óxido que protege al metal del ataque del ácido. Con el cinc pasa algo similar, pero finalmente la capa de óxido es atacada por el ácido nítrico.

Reacción de Quimioluminiscencia


Existen
muchas reacciones químicas que se activan con la luz, y hay otras
tantas en las que la liberación de energia se realiza mediante luz. Son
reacciones quimioluminiscentes.
Al combinar difeniloxalato con perióxido de hidrógeno (agua oxigenada) acompañado en este caso con un colorante fluorescente, se oxida el feniloxalato formandose un peroxiácido muy inestable que descompone en dióxido de carbono. La descomposición es muy energética y excita el colorante, que al desexcitarse genera energia lumínica.
Existen numerosos colorantes (dyes), normalmente relacionados con estructuras de antraceno. Los colorantes mas habituales son:
Al combinar difeniloxalato con perióxido de hidrógeno (agua oxigenada) acompañado en este caso con un colorante fluorescente, se oxida el feniloxalato formandose un peroxiácido muy inestable que descompone en dióxido de carbono. La descomposición es muy energética y excita el colorante, que al desexcitarse genera energia lumínica.
Existen numerosos colorantes (dyes), normalmente relacionados con estructuras de antraceno. Los colorantes mas habituales son:
1- 9,10-Difenilantraceno que da color azul
2- 9,10-bis (difeniletinil)antraceno que da color verde
3- Rubreno que da color amarillo
4- Rodamina 6G que da color naranja
5- Rodamina B que da color rojo


Otro ejemplo mas claro y mas conocido en el laboratorio es el luminol.
La oxidación de éste con sosa y lejía genera el ión aminoftalato y luz
siempre de color azul (debido a la longitud de onda de la energia
transferida). Ciertos seres vivos tambien producen luz mediante
reacciones químicas, como es el caso de las luciernagas. En este caso se
denomina bioluminiscencia e interviene una substancia llamada
luciferina. Lo malo del luminol es que es carísimo y dura pocos
segundos.

Obtención y explosión del hidrógeno a partir de zinc y ácido clohídrico



Al
agregar zinc fragmentado conforme se vas depositando en el tubo se
ensayo con ácido clorhídrico, va reaccionando, esa reacción es de
desplazamiento. Lo que sucede es que el Zn va convirtiéndose a una sal
que es el cloruro de zinc (ZnCl) y al mismo tiempo libera hidrógeno
(H2).
Lo que se hizo en el experimento fue retener el hidrógeno en burbujas dentro de una solución de agua jabonosa, luego se retiro un poco con una cuchara y se lo acerco a una llama. El hidrógeno hizo explosión por ser un gas altamente inflamable. Este gas se produce industrialmente a partir de hidrocarburos como, por ejemplo, el metano. La mayor parte del hidrógeno elemental se obtiene "in situ", es decir, en el lugar y en el momento en el que se necesita. El hidrógeno puede, también, obtenerse a partir del agua por un proceso de electrólisis, pero resulta un método mucho más caro que la obtención a partir del gas natural.
Lo que se hizo en el experimento fue retener el hidrógeno en burbujas dentro de una solución de agua jabonosa, luego se retiro un poco con una cuchara y se lo acerco a una llama. El hidrógeno hizo explosión por ser un gas altamente inflamable. Este gas se produce industrialmente a partir de hidrocarburos como, por ejemplo, el metano. La mayor parte del hidrógeno elemental se obtiene "in situ", es decir, en el lugar y en el momento en el que se necesita. El hidrógeno puede, también, obtenerse a partir del agua por un proceso de electrólisis, pero resulta un método mucho más caro que la obtención a partir del gas natural.

Precipitado de cloruro de plata


Este
precipitado se obtiene a partir de nitrato de plata y cloruro de sodio,
ambos en disolución acuosa. El cloruro de sodio en disolución acuosa se
añade a la disolución de nitrato de plata. Observamos ahora la
formación de un precipitado blanco de cloruro de plata. Este espeso
precipitado se vuelve más grueso y desciende hasta el fondo del tubo de
ensayo a medida que se añade más cantidad de cloruro de sodio acuoso a
la disolución de nitrato de plata. El nitrato de plata se utiliza para
determinar que tanto cloro tiene el agua para que esta ultima ser
consumida por la gente.
Esta sal aparte del análisis de los cloruros, tiene diversos usos aparte como cauterizar heridas, callos de las manos, deteccion de azucares reductores formando el espejo de plata, etc.
Esta sal aparte del análisis de los cloruros, tiene diversos usos aparte como cauterizar heridas, callos de las manos, deteccion de azucares reductores formando el espejo de plata, etc.

Fenolftaleína, indicador de acidos y bases

A
una solución de hidróxido de sodio (sosa caustica) se le vierte un poco
de fenolftaleína con alcohol, el líquido se torna de un color
rojizo-violeta indicando que el hidróxido de sodio es una base


Al
líquido de la reacción anterior se le agrega una solución de ácido
clorhídrico y observamos como poco a poco el líquido se destiñe. La
fenolftaleína no se tiñe de ningún color ante un ácido.

Los
ácidos y bases son dos tipos de sustancias que de una manera sencilla
se pueden caracterizar por las propiedades que manifiestan.
Los químicos usan el pH para indicar de forma precisa la acidez o basicidad de una sustancia. Normalmente oscila entre los valores de 0 (más ácido) y 14 (más básico). En la tabla siguiente aparece el valor del pH para algunas sustancias comunes.
Los indicadores son colorantes orgánicos, que cambian de color según estén en presencia de una sustancia ácida, o básica.
Fenolftaleína, de fórmula C20H14O4, es un compuesto químico que cuando se utiliza como indicador para la determinación cualitativa y cuantitativa del pH en las volumetrías de neutralización se prepara disuelta en alcohol al 70%.El cambio de color de este indicador está acompañado de un cambio de su estructura; su color en medio básico es rojo-violeta y en medio ácido es incoloro.
Los químicos usan el pH para indicar de forma precisa la acidez o basicidad de una sustancia. Normalmente oscila entre los valores de 0 (más ácido) y 14 (más básico). En la tabla siguiente aparece el valor del pH para algunas sustancias comunes.
Los indicadores son colorantes orgánicos, que cambian de color según estén en presencia de una sustancia ácida, o básica.
Fenolftaleína, de fórmula C20H14O4, es un compuesto químico que cuando se utiliza como indicador para la determinación cualitativa y cuantitativa del pH en las volumetrías de neutralización se prepara disuelta en alcohol al 70%.El cambio de color de este indicador está acompañado de un cambio de su estructura; su color en medio básico es rojo-violeta y en medio ácido es incoloro.

La lluvia de oro


Cuando
se mezcla una disolución de yoduro de potasio con una disolución de
nitrato de plomo (II), se forma un precipitado de yoduro de plomo (II),
de color amarillo intenso. También se forma nitrato de potasio pero es
soluble y permanece en disolución:
El yoduro de plomo (II) es un compuesto mucho más soluble en caliente que en frío. Si el recipiente donde se ha dado la reacción anterior se calienta, el precipitado se disuelve y, al enfriarse de nuevo, se forma un precipitado en forma de escamas brillantes, denominado “lluvia de oro”.
El yoduro de plomo (II) obtenido mediante una reacción química (sólido muy insoluble de color amarillo, cuya en agua aumenta al aumentar la temperatura) es una sustancia amorfa, mientras que el obtenido por enfriamiento de una disolución consta de pequeños cristales que parecen oro. Los dos precipitados son, en realidad, la misma molécula. Este fenómeno se conoce como alotropía y cada una de las formas diferentes de presentarse un elemento o un compuesto se denomina “estado alotrópico”.
El yoduro de plomo (II) es un compuesto mucho más soluble en caliente que en frío. Si el recipiente donde se ha dado la reacción anterior se calienta, el precipitado se disuelve y, al enfriarse de nuevo, se forma un precipitado en forma de escamas brillantes, denominado “lluvia de oro”.
El yoduro de plomo (II) obtenido mediante una reacción química (sólido muy insoluble de color amarillo, cuya en agua aumenta al aumentar la temperatura) es una sustancia amorfa, mientras que el obtenido por enfriamiento de una disolución consta de pequeños cristales que parecen oro. Los dos precipitados son, en realidad, la misma molécula. Este fenómeno se conoce como alotropía y cada una de las formas diferentes de presentarse un elemento o un compuesto se denomina “estado alotrópico”.

Bomba de humo con nitrato de potasio y azúcar


Es
una reaccion de oxidación-reducción, o una combustión. Los nitratos son
considerados agentes oxidantes fuertes, ya que son fuentes de oxígeno,
mientras que la sacarosa o azúcar común actua como medio combustible.
Y por ello entendemos la reacción de los nitratos para formar oxígeno, y la reacción del azúcar con el oxígeno, podemos representar la reacción de nitratos con los azúcares.
Pensamos en el nitrato como fuente de oxígeno para el alma de la reacción con el nitrato.
Esta es la reacción que se encuentra comúnmente en luces de bengala, una combinación de nitrato de potasio, azúcar y limaduras de metal. La reacción de azúcar y nitrato hace calor, y el calor excita las limaduras de metal, haciendo que se oxide y emiten luz. También es la reacción principal de combustible para cohetes de azúcar. Una mezcla de azúcar y nitrato de potasio es un buen combustible para cohetes, ya que representa la reacción de los sólidos (nitrato y azúcar) para formar gases (dióxido de carbono y agua). La expansión crea empuje que se utiliza para alimentar el cohete.
Y por ello entendemos la reacción de los nitratos para formar oxígeno, y la reacción del azúcar con el oxígeno, podemos representar la reacción de nitratos con los azúcares.
Pensamos en el nitrato como fuente de oxígeno para el alma de la reacción con el nitrato.
Esta es la reacción que se encuentra comúnmente en luces de bengala, una combinación de nitrato de potasio, azúcar y limaduras de metal. La reacción de azúcar y nitrato hace calor, y el calor excita las limaduras de metal, haciendo que se oxide y emiten luz. También es la reacción principal de combustible para cohetes de azúcar. Una mezcla de azúcar y nitrato de potasio es un buen combustible para cohetes, ya que representa la reacción de los sólidos (nitrato y azúcar) para formar gases (dióxido de carbono y agua). La expansión crea empuje que se utiliza para alimentar el cohete.

Una reacción que enfría (endotérmica)

Mezcla realizada entre cloruro de amonio e hidróxido de bario, abajo del recipiente se añadió un poco de agua

Al
igual que en las reacciones exotérmicas se pueden usar los procesos
fisicoquímicos que absorben calor (endotérmicas) para disminuir la
temperatura del medio que las rodea, así se puede aprovechar por ejemplo
el calor que absorbe el cloruro de Amonio (NH4Cl) al mezclarse con
hidróxido de bario [Ba(OH)2].
En la reacción que nos ocupa, el gran incremento de entropía está relacionado con el incremento en el número de partículas presentes y con sus estados físicos, ya que a partir de dos sólidos se obtiene un sólido más amoniaco acuoso y agua, y hasta desprendimiento de gas, por consiguiente, aumenta considerablemente la entropía y el desorden.
Se hace uso de esta reacción para tener frío instantáneo; experimentalmente si se mezcla NH4Cl con Ba(OH)2 que se encuentra a temperatura ambiente (» 20 ºC), la temperatura del agua disminuye hasta -9ºC, permitiendo un tiempo de acción que dura aproximadamente media hora.
En el caso del experimento que muestro, se vierte un poco de agua debajo del recipiente donde se mezclan los compuestos. La temperatura que alcanza la reacción es suficiente para congelar el agua que esta abajo.
En la reacción que nos ocupa, el gran incremento de entropía está relacionado con el incremento en el número de partículas presentes y con sus estados físicos, ya que a partir de dos sólidos se obtiene un sólido más amoniaco acuoso y agua, y hasta desprendimiento de gas, por consiguiente, aumenta considerablemente la entropía y el desorden.
Se hace uso de esta reacción para tener frío instantáneo; experimentalmente si se mezcla NH4Cl con Ba(OH)2 que se encuentra a temperatura ambiente (» 20 ºC), la temperatura del agua disminuye hasta -9ºC, permitiendo un tiempo de acción que dura aproximadamente media hora.
En el caso del experimento que muestro, se vierte un poco de agua debajo del recipiente donde se mezclan los compuestos. La temperatura que alcanza la reacción es suficiente para congelar el agua que esta abajo.

Obtención de oxígeno puro al permanganato de potasio


Como
se observa, el permanganato de potasio al entrar en contacto con el
agua oxigenada produce una reacción exotérmica y un intenso burbujeo de
gas, que es oxígeno puro.
El permanganato de potasio (KMnO4), es quizás el agente oxidante más comúnmente utilizado en el análisis volumétrico. Es un agente oxidante muy poderoso, de fácil disponibilidad y bajo costo.
En solución ácida, el H2O2 reduce el KMnO4 y se produce oxígeno, es evidente que la reacción señalada es de óxido-reducción.
Por lo general esta reacción se utiliza para determinar el porcentaje de peróxido de hidrógeno en una solución comercial de la misma mediante la valoración del permanganato de potasio. El color púrpura intenso del ión permanganato es suficiente para señalar el punto final, lo cual elimina la necesidad de usar indicadores. Junto a estas ventajas, surgen algunas limitaciones en el uso del KMnO4 debido a su estabilidad limitada, su tendencia a oxidar el ión cloruro y a la multiplicidad de posibles reacciones que puedan producirse.
El permanganato de potasio (KMnO4), es quizás el agente oxidante más comúnmente utilizado en el análisis volumétrico. Es un agente oxidante muy poderoso, de fácil disponibilidad y bajo costo.
En solución ácida, el H2O2 reduce el KMnO4 y se produce oxígeno, es evidente que la reacción señalada es de óxido-reducción.
Por lo general esta reacción se utiliza para determinar el porcentaje de peróxido de hidrógeno en una solución comercial de la misma mediante la valoración del permanganato de potasio. El color púrpura intenso del ión permanganato es suficiente para señalar el punto final, lo cual elimina la necesidad de usar indicadores. Junto a estas ventajas, surgen algunas limitaciones en el uso del KMnO4 debido a su estabilidad limitada, su tendencia a oxidar el ión cloruro y a la multiplicidad de posibles reacciones que puedan producirse.

De azul-verdoso a verde-azulado 





La
solución de sulfato de cobre (II) reacciona con la solución de sal
común (cloruro de sodio) realizando una acción de desplazamiento de
componentes, obteniendo como resultado cloruro de cobre y sulfato de
sodio. En el proceso se observa como la primera solución que es la de
sulfato de cobre cambia de color de azul a verde, esto se debe a que el
verde resultante es el color propio del cloruro de cobre. La otra sal
(nitrato de sodio) al ser incolora en solución no se llega a detectar
pero aun así se encuentra presente.
Este tipo de reacción química es del mismo tipo que en el ejemplo 5 y 7.
Este tipo de reacción química es del mismo tipo que en el ejemplo 5 y 7.

Reacción lumínica del magnesio


Al
someter una cinta de magnesio a un proceso de combustión, en cuestión
de segundos se obtendrá el óxido, además de que la cinta de Mg se
prendera con una llama muy luminosa si se la acerca a una llama y se ira
consumiendo formando un residuo blanco del oxido. El residuo blanco se
llama oxido de magnesio. Antiguamente el magnesio se usaba de esta
manera en las camaras antiguas para crear el "flash"
El oxigeno del aire puede reaccionar con el magnesio si se le proporciona la energía de activación adecuada, que se la proporcionamos con el calor de llama.
La causa del color característico blanco del magnesio se debe a que es su color espectro, lo cual otros metales alcalinos y alcalinoterreos tienen el suyo, esto lo aclararé en la Yapa.
El oxigeno del aire puede reaccionar con el magnesio si se le proporciona la energía de activación adecuada, que se la proporcionamos con el calor de llama.
La causa del color característico blanco del magnesio se debe a que es su color espectro, lo cual otros metales alcalinos y alcalinoterreos tienen el suyo, esto lo aclararé en la Yapa.

Hielo seco instantáneo con acetato de sodio

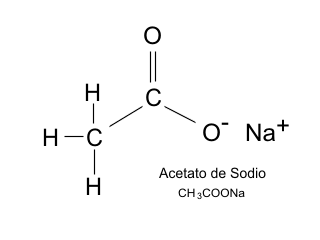
El
acetato de sodio, cuando es calentado y enfriado, se hace supersaturado
en el agua. Entonces al contacto con otro objeto se re-cristaliza. Esta
reacción también causa calor por ello tiene un empleo práctico en
almohadillas de calor. El acetato de sodio también es usado como
conservante y también da a las patatas chips de vinagre su gusto
distintivo. Aparece en los productos alimenticios como E262 o diacetato
de sodio.
Esta reacción es reversible y puede volver a hacerse utilizando el mismo material, se trata de un cambio físico y no de un cambio químico, ya que los compuestos que intervienen no cambian su estructura fundamental. Las únicas transformaciones implicadas son uniones y desuniones entre moléculas de agua y una sal metálica en la cual pasa de un estado líquido a un estado sólido. Esta reacción fue observada por Gay-Lussac.
Esta reacción es reversible y puede volver a hacerse utilizando el mismo material, se trata de un cambio físico y no de un cambio químico, ya que los compuestos que intervienen no cambian su estructura fundamental. Las únicas transformaciones implicadas son uniones y desuniones entre moléculas de agua y una sal metálica en la cual pasa de un estado líquido a un estado sólido. Esta reacción fue observada por Gay-Lussac.

Humo violeta producto de Yodo y aluminio


Reacción
exotérmica de combinación de Yodo con Aluminio a Yoduro de aluminio
(AlI3) catalizado por una gota de agua. Esta reacción química produce
nubes de color púrpura, que es principalmente vapores de yodo, yoduro de
aluminio, y un poco de yoduro de hidrógeno también. Esta mezcla se
podria utilizar para fabricar fuentes que se inicien por agua en vez de
fuego, el problema es inventarse un método eficaz para que no corramos
ningún riesgo al hacerlo. Este tipo de reacción química es la misma que
la del ejemplo 2.

Volcán de dicromato de amonio


El
dicromato de amonio es una sal del hipotético ácido dicrómico (este
ácido no es un compuesto estable). Se trata de una sustancia con un
color anaranjado intenso. Es un oxidante fuerte y en contacto con
sustancias orgánicas puede producir explosiones e incendios.
Es fundamentalmente conocido por su uso en la demostración de la descomposición térmica de una sustancia, ya que al ser calentada o encendida por una llama.
La reacción se produce debido al poder oxidante del ion dicromato y al reductor del ion amonio. Otro ejemplo es la reacción de descomposición explosiva del nitrato de amonio. Actualmente esta experiencia se realiza cada vez menos debido a la toxicidad de uno de los productos: el óxido de cromo III.
Es fundamentalmente conocido por su uso en la demostración de la descomposición térmica de una sustancia, ya que al ser calentada o encendida por una llama.
La reacción se produce debido al poder oxidante del ion dicromato y al reductor del ion amonio. Otro ejemplo es la reacción de descomposición explosiva del nitrato de amonio. Actualmente esta experiencia se realiza cada vez menos debido a la toxicidad de uno de los productos: el óxido de cromo III.

Yapa
Link: http://www.youtube.com/watch?v=-BnKeBMG-8M

Antes
de que existiesen analizadores de espectros los científicos eran
capaces de distinguir los compuestos en base al color que emitían al
exponerse a llama.
Así el sodio siempre daba color naranja al fuego, el boro color verde y el cobre color azul.
Así el sodio siempre daba color naranja al fuego, el boro color verde y el cobre color azul.
Link: http://www.youtube.com/watch?v=jJvS4uc4TbU

Estos
espectros siguen siendo utilizados en pirotecnia. Los expertos saben
como mezclar los diferentes compuestos para obtener el color deseado en
el fuego artificial.
FUENTE

Gracias por pasar 




Otros posts que te pueden interesar:
 Caleidoscopio ¿Cómo funciona? + Yapa
Caleidoscopio ¿Cómo funciona? + Yapa
 Recolección de Gifs graciosos
Recolección de Gifs graciosos



